Ungkapan "like dissolve like" berarti hanya pelarut polar yang dapat melarutkan senyawa polar. pelarutan (solvatasi) melibatkan pemutusan interaksi antarmolekul dari zat yang dilarutkan (solut) dan menggantikannya dengan interaksi antara solut dengan pelarut.
pelarut takpolar tidak dapat berinteraksi dengan solut polar dan karenanya, tidak dapat melarutkan senyawa polar. zat padat atau cair takpolar tidak dapat larut dalam pelarut polar. interaksi baru antara solut takpolar dengan pelarut polar tidak cukup kuat untuk menggantikan interaksi dipol-dipol yang menstabilkan molekul-molekul pelarut misalnya minyak (takpolar) dan H2O tidak bercampur. namun senyawa takpolar bisa larut dalam pelarut takpolar karena molekul-molekul pelarut takpolar tidak disatukan oleh interaksi antarmolekul yang kuat.
sumber: intisari kimia organik by Stephen Bresnick, M.D
Minggu, 22 Mei 2011
Daya Larut dan Solvatasi
Diposting oleh Rabiati Alimuddin di 18.41 0 komentar
Label: kimia organik
Jumat, 20 Mei 2011
Struktur Serta Sifat Fisik Alkena dan Alkuna
Diposting oleh Rabiati Alimuddin di 07.38 0 komentar
Label: kimia organik
Sabtu, 14 Mei 2011
Banjir dan Penyebabnya
Banjir adalah peristiwa terbenamnya daratan oleh air. hal ini terjadi ketika sungai tidak mampu lagi menampung debit air yang besar sehingga air meluap memenuhi sungai dan meluber ke daerah sekitarnya. luapan air sungai ini akan merendam semua daerah yang lebih rendah darinya. Banjir adalah ancaman musiman yang terjadi apabila meluapnya tubuh air dari saluran yang ada dan menggenangi wilayah sekitarnya. Banjir adalah ancaman alam yang paling sering terjadi dan paling banyak merugikan, baik dari segi kemanusiaan maupun ekonomi. Sembilan puluh persen dari kejadian bencana alam (tidak termasuk bencana kekeringan) berhubungan dengan banjir. Jenis banjir yang sering terjadi: bandang atau kiriman dan pasang-surut. beberapa penyebab terjadinya banjir yaitu:
Diposting oleh Rabiati Alimuddin di 09.08 0 komentar
Label: lingkungan
Jumat, 13 Mei 2011
Sampah
Diposting oleh Rabiati Alimuddin di 20.30 0 komentar
Label: kimia anorganik, lingkungan
Kamis, 12 Mei 2011
rekayasa genetika
Diposting oleh Rabiati Alimuddin di 07.46 0 komentar
Label: biokimia
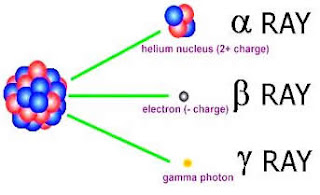
Penemuan Radioaktif dan Sinar X
- Sinar-X dipancarkan dari tempat yang paling kuat tersinari oleh sinar katoda.
- Intensitas cahaya yang dihasilkan pelat fotoluminesensi, berbanding terbalik dengan kuadrat jarak antara titik terjadinya sinar-X dengan pelat fotoluminesensi. Meskipun pelat dijauhkan sekitar 2 m, cahaya masih dapat terdeteksi.
- Sinar-X dapat menembus buku 1000 halaman tetapi hampir seluruhnya terserap oleh timbal setebal 1,5 mm.
- Pelat fotografi sensitif terhadap sinar-X.
- Ketika tangan terpapari sinar-X di atas pelat fotografi, maka akan tergambar foto tulang tersebut pada pelat fotografi.
- Lintasan sinar-X tidak dibelokkan oleh medan magnet (daya tembus dan lintasan yang tidak terbelokkan oleh medan magnet merupakan sifat yang membuat sinar-X berbeda dengan sinar katoda).
Diposting oleh Rabiati Alimuddin di 07.11 0 komentar
Label: kimia radiasi
Sabtu, 07 Mei 2011
gravimetri
Diposting oleh Rabiati Alimuddin di 20.14 0 komentar
Label: kimia analitik
Kompleksometri
Diposting oleh Rabiati Alimuddin di 08.36 0 komentar
Label: kimia analitik
Argentometri
Diposting oleh Rabiati Alimuddin di 08.12 0 komentar
Label: kimia analitik
Kamis, 05 Mei 2011
Elektrokimia
Elektrokimia adalah cabang ilmu kimia yang berkenaan dengan interkonversi energi listrik dan energi kimia. Proses elektrokimia adalah reaksi redoks (oksidasi-reduksi) dimana dalam reaksi ini energi yang dilepas oleh reaksi spontan diubah menjadi listrik atau dimana energi listrik digunakan agar reaksi yang nonspontan bisa terjadi (Chang, 2005).
Sel elektrokimia adalah sel yang terdiri dari dua elektroda atau konduktor logam, yang dicelupkan ke dalam elektrolit koduktor ion ( yang dapat berupa cairan, larutan atau padatan). Elektroda dan elektrolitnya membentuk kompartemen elektroda. kedua elektroda dapat menempati kompartemen yang sama. Jika elektrolitnya berbeda, kedua kompartemen dapat dihubungkan dengan jembatan garam, yaitu larutan elektrolit yang melengkapi sirkuit listrik dan memungkinkan sel itu berfungsi (Atkins, 1994).
Reaksi elektrokimia dapat digunakan untuk mengubah energi kimia menjadi energi listrik. Sel elektrokimia adalah alat yang digunakan untuk melangsungkan perubahan diatas. Dalam sebuah sel, energi listrik dihasilkan dengan jalan pelepasan elektron pada suatu elektroda (oksidasi) dan penerimaan elektron pada elektroda lainnya (reduksi). Elektroda yang melepaskan elektron dinamakan anoda sedangkan elektroda yang menerima elektron dinamakan katoda. Jadi, sebuah sel selalu terdiri dari dua bagian atau dua elektroda, setengah reaksi oksidasi akan berlangsung pada anoda dan setengah reaksi reduksi akan berlangsung pada katoda. Dengan kata lain pada sel elektroda kimia, kedua setengah reksi dipisahkan dengan maksud agar aliran listrik (elektron) yang ditimbulkan dapat dipergunakan. Salah satu
Diposting oleh Rabiati Alimuddin di 17.07 3 komentar
Label: kimia fisik
Ligan-
Dalam ilmu kimia, kompleks atau senyawa koordinasi merujuk pada molekul atau entitas yang terbentuk dari penggabungan ligan dan ion logam. Dulunya, sebuah kompleks artinya asosiasi reversibel dari molekul, atom, atau ion melalui ikatan kimia yang lemah. Pengertian ini sekarang telah berubah. Beberapa kompleks logam terbentuk secara irreversibel, dan banyak diantara mereka yang memiliki ikatan yang cukup kuat (Anonim, 2009).
Ligan adalah spesies yang memiliki atom-atom yang dapat menyumbangkan sepasang elektron pada ion logam pusat pada tempat tertentu dalam lengkung koordinasi. Sehingga, ligan merupakan basa lewis dan ion logam adalah asam lewis. Jika ligan hanya dapat menyumbangkan sepasang elektron (misalnya NH3 melalui atom N) disebut ligan unidentat. Ligan ini mungkin merupakan anion monoatomik (tetapi bukan atom netral) seperti ion halida, anion poliatomik seperti NO2-, molekul sederhana seperti NH3 atau molekul kompleks seperti piridin C5H5N (Petrucci, 1987).
Di antara ciri-ciri khas ligan yang umum diakui sebagai mempengaruhi kestabilan kompleks dalam mana ligan itu terlibat, adalah :
a. kekuatan basa dari ligan itu,
b. sifat-sifat penyepitan (jika ada), dan
c. efek-efek sterik (ruang)
Dari sudut pandangan aplikasi kompleks secara analisis, efek penyepitan mempunyai arti yang teramat penting, maka hendaklah diperhatikan secara khusus. Istilah ‘efek sepit’ mengacu pada fakta bahwa suatu kompleks bersepit, yaitu kompleks yang dibentuk oleh suatu ligan bedentat atua multidentat, adalah lebiih stabil disbanding kompleks padanannya denga ligan-ligan monodentat: semakin banyak titik lekat ligan itu kepada ion logam,semakin besar kestabilan kompleks. Efek sepit ini sering dapat disebabkan oleh kenaikan entropi yang menyertai penyempitan; dalam hubungan ini, penggantian molekul-molekul air dari ion terhidrasi haruslah diingat-ingat. Efek sterik yang paling umum adalah efek
Diposting oleh Rabiati Alimuddin di 15.53 0 komentar
Label: kimia anorganik
-Sifat Oksidasi Reduksi Logam-
Dari sejarahnya istilah oksidasi reduksi diterapkan untuk proses dimana oksigen dapat diambil oleh suatu zat. Maka reduksi dianggap sebagai proses dimana oksigen diambil dari dalam suatu zat. Kemudian penangkapan hidrogen juga disebut sebagai reduksi, sehingga kehilangan hidrogen harus disebut oksidasi. Sekali lagi reaksi-reaksi lain dimana baik oksigen maupun hidrogen tidak stabil bagian belum dapat dikelompokkan sebagai oksidasi reduksi sebelum defenisi oksidasi reduksi yang paling umum, yang didasarkan pada pelepasan dan pengambilan elektron disusun orang. Sebelum mencoba mendefenisikan dengan lebih cermat apa arti istilah-istilah itu, sebaiknya diperiksa beberapa reaksi (Svehla, 1990).
Suatu reaksi redoks adalah reaksi dalam mana terdapat perubahan dalam keadaan-keadaan oksidasi. Oksidasi dan reduksi selalu terjadi dengan serempak karena kenaikan keadaan oksidasi untuk satu spesi selalu disertai penurunan keadaan oksidasi untuk spesi lain. Oksidasi didefinisikan dalam arti luas sebagai suatu reaksi dalam mana atom atau ion mengalami kenaikan dalam keadaan oksidasi. Reaksi setengah dalam mana elektron diterimah adalah suatu reduksi. Reduksi didefisikan dalam arti luas sebagai suatu reaksi dalam mana atom atau ion mengalami suatu penurunan dalam keadaan oksidasi. Dalam suatu reaksi antara suatu logam dan suatu bukan logam, logam itu selalu merupakan bahan pereduksi dan bukan logam selalu merupakan bahan pengoksida (Keenan, dkk., 1984).
Oksidasi adalah suatu proses yang mengaakibatkan hilangnya satu elektron atau lebih dari dalam zat (atom, ion, atau molekul). Bila suatu unsur dioksidasi, keadaan oksidanya berubah ke harga yang lebih positif. Suatu zat pengoksidasi adalah zat yang memperoleh elektron, dan dalam proses itu zat itu direduksi. Definisi oksidasi ini sangat umum, karena itu berlaku pula pada proses dalam zat padat, lelehan maupun gas. Sedangkan reduksi adalah sebaliknya yakni suatu proses yang mengakibatkan diperolehnya satu elektron atau lebih oleh zat. Bila suatu unsur direduksi, keadaan oksidasi berubah
Diposting oleh Rabiati Alimuddin di 15.47 0 komentar
Label: kimia anorganik
--ProTein--
Diposting oleh Rabiati Alimuddin di 02.13 0 komentar
Label: biokimia
lemak dan minyak
Hampir semua bahan pangan banyak mengandung lemak dan minyak, terutama yang berasal dari hewan. Lemak dalam jaringan hewan terdapat pada jaringan adiposa. Dalam tanaman, lemak disintesis dari satu molekul gliserol dengan tiga molekul asam lemak yang terbentuk dari kelanjutan oksidasi karbohidrat dalam proses respirasi. Proses pembentukan lemak dalam tanaman dapat dibagi menjadi tiga tahap yaitu pembentukan gliserol, pembentukan molekul asam lemak dan kemudian kondensasi asam lemak dengan gliserol membentuk lemak (Winarno, 2004).
Lemak merupakan senyawa yang larut dalam air yang dapat dipisahkan dari sel dan jaringan dengan cara ekstraksi menggunakan pelarut organik yang relatif non polar, misalnya dietil eter atau kloroform. Oleh sebab itu, senyawa ini dibagi menurut sifat fisiknya yaitu senyawa yang larut dalam pelarut non polar dan yang tidak larut dalam air dan tidak dibagi menurut strukturnya. Meskipun struktur lemak bermacam-macam, semua lemak mempunyai sifat struktur yang spesifik, yaitu mempunyai gugusan hidrokarbon hidrofob yang banyak sekali dan hany sedikit, jika ada, gugusan hidrokarbon hidrofil. Hal ini menggambarkan sifat struktur lemak yang tidak larut dalam air tetapi larut dalam pelarut non polar. Perbedaan lemak dan minyak adalah pada sifat fisiknya. Pada temperatur kamar, lemak bersifat padat dan minyak bersifat cair. Suatu kekecualian adalah minyak nabati yaitu minyak kelapa, yang mencair pada temperatur 21-25ºC, hampir sama dengan temperatur kamar di daerah beriklim dingin dan di bawah temperatur kamar di daerah tropis. Lemak dan minyak pada umumnya merupakan trigliserida yang tidak homogen dengan beberapa kekecualian. Oleh sebab itu kebanyakan trigliserida mengandung dua atau tiga asam lemak yang berbeda, misalnya satu asam palmitat, satu asam stearat dan satu asam oleat sebagai esternya. Golongan asam lemak yang spesifik yang ada dalam trigliserida tergantung pada jenis spesies dan kondisi lainnya (Fessenden dan Fessenden, 1994).
Lemak dan minyak termasuk dalam kelompok senyawa yang disebut lipida, yang pada umumnya mempunyai sifat sama yaitu tidak larut dalam air. Pada umumnya untuk pengertian sehari-hari lemak merupakan bahan padat pada suhu kamar, sedang minyak dalam bentuk cair dalam suhu kamar, tetapi keduanya terdiri dari molekul-molekul trigliserida. Lemak merupakan bahan padat pada suhu kamar, diantaranya disebabkan kandungannya yang tinggi akan asam lemak jenuh yang secara kimia tidak mengandung ikatan rangkap, sehingga mempunyai titik lebur yang lebih tinggi. Minyak merupakan
Diposting oleh Rabiati Alimuddin di 02.05 0 komentar
Label: biokimia
trigliserida
Diposting oleh Rabiati Alimuddin di 01.42 0 komentar
Label: biokimia